תוֹכֶן
כאשר קובעים את המטען הרשמי של מולקולה כגון COCl2 (גז פוסגן), יש צורך לדעת את מספר האלקטרונים בשכבת הערכיות של כל אטום ומבנה לואיס של המולקולה.
הוראות

-
חפש כל אטום בטבלה המחזורית של האלמנטים כדי לקבוע את מספר האלקטרונים בשכבת הערכיות.
-
נזכיר כי שני אלקטרונים הם ברמת המשנה הראשונה s, שניים נמצאים המשנה השני ברמת s, שישה אלקטרונים ברמת המשנה הראשונה p, וכן הלאה. כזכור: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
הכה את העומס. אם המולקולה היא יון, להוסיף או להחסיר אחד או יותר electrons מכלל להגיע המטען הסופי.
-
עבור COCl2 (גז פוסגן): C = 4; O = 6; Cl = 7. המולקולה אינה מיננת ויש לה מטען נייטרלי. לכן, המספר הכולל של אלקטרונים בשכבת הערכיות הוא 4 + 6 + (7x2) = 24.
מספר אלקטרונים בשכבת הערכיות
-
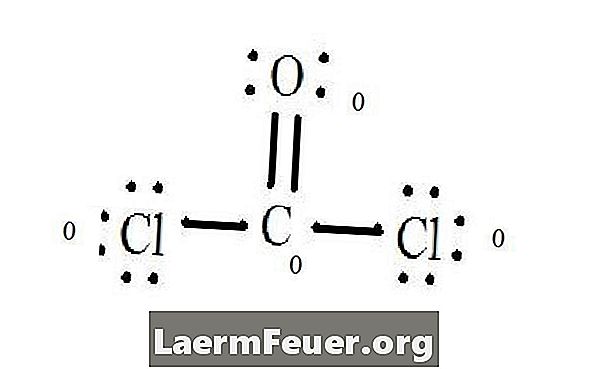
ראה דיאגרמת מבנה לואיס של COCl2 (גז פוסגן). מבנה לואיס מייצג את המבנה היציב והסתבר ביותר למולקולה. האטומים משורטטים עם אלקטרונים ערכיות זיווג; קשרים נוצרים בין אלקטרונים חופשיים כדי לספק את כלל האוקטטים.
-
צייר כל אטום ואת האלקטרונים הערכיות שלה ולאחר מכן ליצור קשרים לפי הצורך.
אלקטרונים משורטטים על מבנה לואיס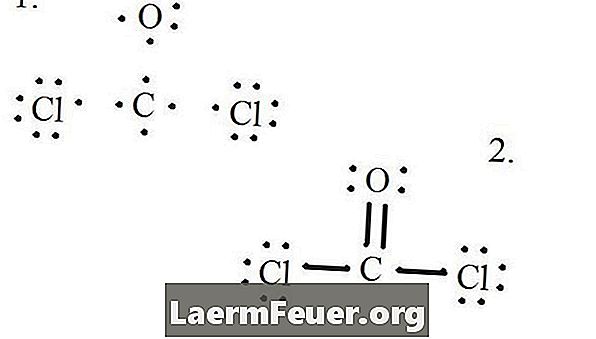
-
אטומי כלוריד חולקים קשרים בודדים עם מולקולת הפחמן, ואילו אטום החמצן יוצר קשר כפול עם פחמן. כל אטום במבנה הסופי מספק את הכלל אוקטט ויש לו שמונה אלקטרונים בשכבת הערכיות, המאפשר יציבות מולקולרית.
מבנה לואיס
-
ספור את זוגות האלקטרון החופשיים של כל אטום במבנה לואיס. כל אטום מייעד אלקטרונים של כל קשר שממנו הוא משתתף. הוסף מספרים אלה. ב CoCl2: C = 0 זוגות חינם בתוספת 4 אלקטרונים הבונד = 4 אלקטרונים. O = 4 אלקטרונים של זוגות חינם + 2 אלקטרונים של אג"ח = 6 אלקטרונים. Cl = 6 אלקטרונים של זוגות חינם ועוד אלקטרון אחד של קשר אחד עם C = 7 אלקטרונים.
-
הפחת את כמות מספר האלקטרונים בשכבת הערכיות על האטום הלא מאוגד. התוצאה היא תשלום רשמי עבור כל אטום. ב COCl2: C = 4 אלקטרונים הערכיות (ev) באטום מאוגד פחות 4 אלקטרונים המיועדים במבנה לואיס (LS) = 0 טעינה רשמית O = 6 ev - 6 LS = 0 טעינה רשמית Cl = 7 ו- LS = 0 תשלום רשמי
חיובים רשמיים של אטומים
-
בעת הכתיבה, במקום אלה חיובים ליד האטומים במבנה לואיס. אם במולקולה יש תשלום, הניחו את מבנה לואיס בסוגריים עם המטען שנכתב מבחוץ בפינה הימנית העליונה.
תשלום רשמי של כל אטום
שים לב
- חישוב המטען הפורמלי עבור מולקולות המכילות מתכות מעבר יכול להיות בוגדני. מספר האלקטרונים בשכבת הערכיות עבור מתכות המעבר יהיה אלה מתוך דפוס גז אציל.
מה שאתה צריך
- לוח תקופתי של היסודות