
תוֹכֶן
Catalase הוא אנזים נמצא בתאים של בעלי חיים, צמחים וחיידקים אירוביים. אנזים הוא מולקולה גדולה, מסונתזת בתאים ומייצרת לפעול כזרז בתגובה. כל סוג של אנזים מבצע פונקציה מסוימת, ואת הפונקציה של catalase היא להמיר מוצר מזיק פוטנציאלי אלמנטים שימושיים עבור התא.

פונקציה
Catalase, כמו רוב האנזימים, הוא חלבון. זה נמצא peroxisomes, שהם קרומי תאים התא. קטלאז יש תפקיד ביולוגי חשוב: הוא מזרז את התמוטטות של מי חמצן, חומר רעיל לאורגניזמים, לתוך מים וחמצן מולקולרי, אשר הן מזיקים ושימושיים.

מבנה
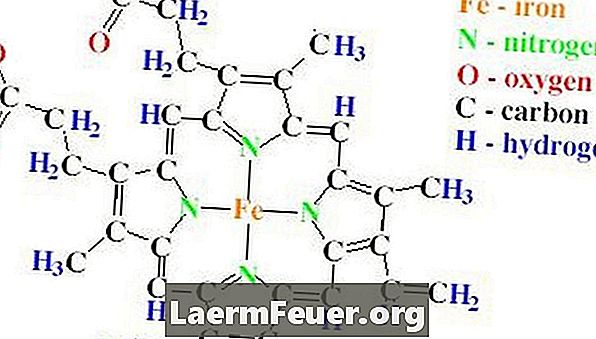
מבנה משקולת של קטליז מכיל ארבע שרשראות פוליפפטיד, שכל אחד מהם מכיל יותר מ 500 חומצות אמינו. קטלאז יש גם ארבע קבוצות heme, אשר עשויים טבעות protoporphyrin, המכיל אטום ברזל יחיד. טבעות אלה שוכנים בתוך ארבע שרשראות.
החשיבות של catalase
מי חמצן הוא תוצר לוואי של פונקציות ביולוגיות רבות של אורגניזמים. כל אורגניזמים אירוביים להשתמש חמצן בנשימה. הפחתת החמצן במים היא לעתים קרובות לא שלם, וכן אלקטרון נוסף של יון מתכת ניתן להעביר, יצירת היווצרות חמצן. עם זאת, רוב מי חמצן נוצר במהלך הייצור של ה- ATP במיטוכונדריה. למרות מי חמצן הוא רעיל לתאים חיים, התגובה לשבור אותו בחזרה לתוך המים והחמצן מתרחשת במהירות וביעילות. Catalase ידוע בתור אחד האנזימים היעילים ביותר, עם מחזור של כ 200,000 אירועים / השני / משנה. ללא catalase כדי להגדיל את שיעור התגובות, מי חמצן יישאר, מזיק לתאים.
גורמים המשפיעים על האפקטיביות של catalase
Catalase ושיעור הפעילות שלה משתנים על ידי מספר גורמים, כולל טמפרטורה, pH, ריכוז מלח, כמות המצע ואת נוכחותם של מעכבים או activators. טמפרטורה היא גורם חשוב בכל התגובות ביוכימיים, שכן טמפרטורה גבוהה עלולה לגרום denaturation של האנזימים. כאשר האנזים הוא מפוגל, הוא משנה את הקונפורמציה שלו, גורם המצע לאגד פחות יעיל, ובכך להקטין את קצב התגובה. מצד שני, עד הטמפרטורה המקסימלית (אשר שונה עבור כל סוג של קטלז) הוא הגיע, שיעור התגובה יגדל יחד עם הטמפרטורה. ה- pH, מדד החומציות או הריכוז של יוני המימן בפתרון, נמדד בסולם של 0 עד 14. כאשר הפתרון הופך לחומצי יותר (מתחת ל -7), האנזים יכול לקבל יון מימן מהפתרון , וכפי שהפתרון הופך להיות בסיסי יותר (מעל 7), הוא עלול לאבד יון מימן. אחד משני הקצוות הללו יכול להפחית את שיעור התגובה, מאז catalase קשרים כימיים משתנים. ישנם שני סוגים של מעכבים: מעכבים לא תחרותיים, אשר נקשרים לאתר שאינו האתר הפעיל, ומעכבים תחרותיים, אשר נקשרים לאתר הפעיל של קטליז. נחושת גופרתי הוא ידוע לא תחרותי inhibitor של catalase, ו ציאניד ידוע בתור מעכב תחרותי. באופן כללי, כמו כמות של מי חמצן מגביר, קצב התגובה יגדל גם. עם זאת, התגובות האנזימטיות עוקבות אחר משוואת מיכאליס-מנטן, האומרת שכל תגובה תגיע לנקודת רוויה, כלומר, בקצב תגובה מקסימלי, תוספת של מצע יותר לא תהיה עוד השפעה.
שימושים אחרים של קטליז
כמו catalase קיים כמעט כל אורגניזמים החיים, הוא אחד האנזימים הנחקרים ביותר. זה הוביל מדענים למצוא פונקציות אחרות עבור אנזים זה יעיל. Catalase משמש לטיפול בפנים של פלסטיק לארוז מזון. זה מונע חמצון, ולכן מסייע לשמור על מזון. Catalase משמש גם במהלך תהליך העיקור קר שהוא תהליך לשימור חלב וגבינה על ידי טיפול עם מי חמצן. אנזים זה משמש כדי להסיר את כל עקבות הנותרים של מי חמצן.