תוֹכֶן
- מספר האלקטרונים במעטפת הערכיות
- שלב 1
- שלב 2
- שלב 3
- שלב 4
- מבנה לואיס
- שלב 1
- שלב 2
- שלב 3
- מטען פורמלי של כל אטום
- שלב 1
- שלב 2
- שלב 3
בעת קביעת המטען הפורמלי של מולקולה כגון CoCl2 (גז פוסגן), יש לדעת את מספר האלקטרונים בשכבת הערכיות של כל אטום ואת מבנה לואיס של המולקולה.
מספר האלקטרונים במעטפת הערכיות
שלב 1
חפש כל אטום בטבלה המחזורית של היסודות כדי לקבוע את מספר האלקטרונים במעטפת הערכיות.
שלב 2
זכרו ששני אלקטרונים נמצאים בתת-הרמה הראשונה s, שניים הם בתת-הרמה השנייה, שישה אלקטרונים בתת-הרמה הראשונה p וכו '. זכור: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
שלב 3
הכה בעומס. אם המולקולה היא יון, הוסף או חיסר אלקטרונים אחד או יותר מהסך הכל כדי להגיע למטען הסופי.
שלב 4
עבור CoCl2 (גז פוסגן): C = 4; O = 6; Cl = 7. המולקולה אינה מיוננת ובעלת מטען ניטרלי. לכן, המספר הכולל של האלקטרונים במעטפת הערכיות הוא 4 + 6 + (7x2) = 24.
מבנה לואיס
שלב 1
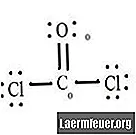
ראה את התרשים של מבנה לואיס של CoCl2 (גז פוסגן). מבנה לואיס מייצג את המבנה היציב והסביר ביותר עבור המולקולה. אטומים נמשכים באמצעות אלקטרוני ערכיות זוגיים; קשרים נוצרים בין אלקטרונים חופשיים כדי לספק את כלל האוקטט.
שלב 2

צייר כל אטום ואלקטרוני הערכיות שלו ואז צור קשרים לפי הצורך.
שלב 3
אטומי כלוריד חולקים קשרים פשוטים עם מולקולת הפחמן, ואילו אטום החמצן יוצר קשר כפול עם פחמן. כל אטום במבנה הסופי מספק את כלל האוקטט ויש לו שמונה אלקטרונים בקליפת הערכיות, מה שמאפשר יציבות מולקולרית.
מטען פורמלי של כל אטום
שלב 1
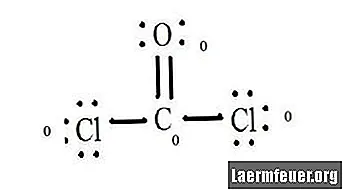
ספר את הזוגות נטולי האלקטרונים של כל אטום במבנה לואיס. לכל אטום מוקצה אלקטרון מכל קשר בו הוא משתתף. הוסף את המספרים האלה. ב- CoCl2: C = 0 זוגות חופשיים בתוספת 4 אלקטרונים של קשרים = 4 אלקטרונים. O = 4 אלקטרונים של זוגות חופשיים בתוספת 2 אלקטרונים של קשרים = 6 אלקטרונים. Cl = 6 אלקטרונים של זוגות חופשיים בתוספת אלקטרון אחד של קשר עם C = 7 אלקטרונים.
שלב 2
מחסרים את כמות מספר האלקטרונים בקליפת הערכיות באטום הלא מאוגד. התוצאה היא החיוב הפורמלי לכל אטום. ב- CoCl2: C = 4 אלקטרוני ערכיות (ev) באטום הלא מאוגד פחות 4 אלקטרונים המיועדים במבנה לואיס (LS) = 0 מטען פורמלי O = 6 ev - 6 LS = 0 מטען פורמלי Cl = 7 ev - 7 LS = 0 מטען רשמי
שלב 3
בעת כתיבה, הצב מטענים אלה קרוב לאטומים במבנה לואיס. אם למולקולה יש מטען בסך הכל, הציבו את מבנה לואיס בסוגריים כאשר המטען כתוב בחוץ בפינה הימנית העליונה.