
תוֹכֶן
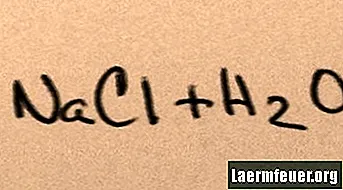
כאשר מוסיפים מלח למים, הוא מתמוסס למולקולות המרכיב שלו עד שיוני המלח המרבי שהמים יכולים לתמוך בו צפים סביב מולקולות המימן והחמצן. כאשר זה קורה, הפתרון נקרא "רווי". כאשר מומס יותר מלח, יוני נתרן וכלור מתנגשים זה בזה ומשלבים מחדש בגבישי מלח. תופעה זו מכונה "משקעים", מכיוון שהמוצק הנוצר נופל לקרקעית המים. מלחים הם "הידרופיליים", כלומר הם נמשכים למים. אטרקציה זו מאפשרת צורה מוכרת של משקעים: טיפות גשם נוצרות סביב גבישי מלח זעירים בעננים, מה שהופך אותו לטעם מעט מלוח.
הבסיס

אלקטרוליטים

מלח אינו מוליך חשמל במצב מוצק, אך במצב נוזלי (נוזלי) הוא יוצר פיתרון שיכול להוביל חשמל בצורה טובה מאוד. מוליכות תלויה בסוג המלח בו משתמשים, אך נוזלים אלה, הנקראים תמיסות אלקטרוליטים, הם נושאים מצוינים של תרכובות הדרושות לגוף האדם. הדחפים החשמליים שיוצר המוח מייצרים חמצן חופשי המשמש את הדם. מולקולות המלח מסווגות לאלקטרוליטים (נתרן, אשלגן או סידן) ולכלורידים בתמיסה: הכלוריד נשאב על ידי הדם והכליות לשתן, והאלקטרוליטים מופצים דרך המערכת הנוירו-שרירית בתהליך שאתלטים מכנים. התייבשות.
תכונות קולגטיביות

כל פתרון שונה מהרכבו המקורי מכיוון שתוספת מולקולות, גם כאשר אינן יוצרות תרכובות חדשות, משנה את משקל הנוזל המולקולרי ומשפיעה על תכונותיו. מי מלח צפופים יותר ממים טהורים וגם קופאים לאט יותר. אולם כאשר הוא קופא, המלח נודד לגבולות הנוזל, מה שהופך אותו לכבד יותר ורווי יותר ואז מוריד את נקודת הקפיאה שלו. בקצה השני של מצב החומר, ככל שמי המלח צפופים יותר, כך הם דורשים יותר אידוי להתאדות, עד שהמים נגמרים, ומשאירים שכבת מלח. טבחים מחכים שהמים בסיר ירתחו כדי להוסיף מלח, כדי לא לעכב את החימום. איכויות אלה, המכונות "תכונות קולגטיביות", מסייעות למדענים לקבוע את המשקל המולקולרי של מי המלח. אם ניתן למדוד את המסה, הלחץ האטמוספרי ונקודת הרתיחה של הנוזל, אזי מדענים יכולים להפחית את המשקל המולקולרי של המים כדי לגלות אילו מלחים קיימים.