תוֹכֶן
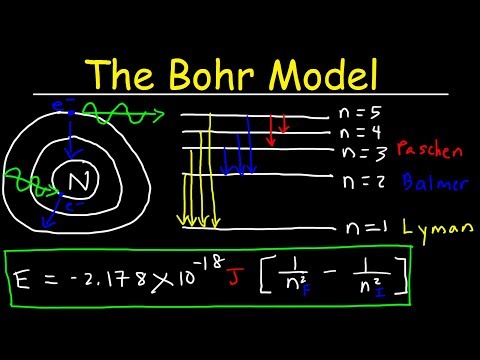
סדרת באלמר הוא ייעודו של קווי ספקטרלי של פליטת אטום מימן. קווים ספקטרליים אלה, שהם פרוטונים הנפלטים בספקטרום האור הנראה, מיוצרים מהאנרגיה הדרושה להסרת אלקטרון מאטום הנקרא אנרגיה מיננת. כי אטום המימן יש רק אלקטרון אחד, האנרגיה הדרושה כדי להסיר אותו נקרא האנרגיה מיונן הראשון (אבל במקרה של מימן, אין שנייה). זה יכול להיות מחושב באמצעות סדרה של צעדים קטנים.
הוראות

-
לקבוע את מצבי האנרגיה הראשונית והאחרונה של האטום ולמצוא את ההבדל של ההופך שלה. עבור הרמה הראשונה של יינון, מצב האנרגיה הסופי הוא אינסופי, שכן האלקטרון מוסר מן האטום, כך ההופכי של המספר הזה הוא 0. מצב האנרגיה הראשונית היא 1, המדינה היחידה כי אטום המימן יכול להיות, ואת ההופכי של 1 הוא 1. ההבדל בין 1 ל 0 הוא 1.
-
להכפיל את רידברג קבוע (מספר חשוב בתיאוריה האטומית), אשר יש ערך של 1,097 x 10 ^ (7) למטר (1 / m), על ידי ההבדל של ההפך של רמות האנרגיה, אשר במקרה זה הוא 1. זה ייתן את הערך המקורי של קבוע רידברג.
-
חישוב ההופכי של התוצאה A, כלומר, לחלק את מספר 1 על ידי תוצאה של א 'זה ייתן ערך של 9.11 x 10 ^ (- 8) מ'; זהו אורך הגל של פליטת הספקטרום.
-
הכפל קבוע של פלאנק על ידי מהירות האור ולחלק את התוצאה על ידי אורך גל פליטה. הכפלת קבוע פלנק, אשר יש לו ערך של 6,626 x 10 ^ (-34) פעמים Joule פעמים (J) על ידי מהירות האור, אשר יש ערך של 3.00 x 10 ^ 8 מטרים לשנייה (m / s ), אנו מקבלים 1.988 x 10 ^ (- 25) Joule פעמים מטרים (J מ '), ואת חלוקת זה על ידי אורך הגל (אשר שווה 9.11 x 10 ^ (-8) מ'), אנו מקבלים 2.182 x 10 ^ (-18) ג. זהו אנרגיית היינון הראשונה של אטום המימן.
-
הכפל את האנרגיה יינון על ידי מספר של Avogadro, אשר יביא את מספר החלקיקים בשומה אחת של החומר. הכפלת 2,182 x 10 ((-18) J על ידי 6.022 x 10 (23), התוצאה היא 1.312 x 106 ג 'אול למול (J / mol), או 1312 kJ / mol, שהוא כפי שנכתב בדרך כלל כימיה.